Le test NovaGray RILA® mesure l’apoptose des lymphocytes après irradiation pour estimer la radiosensibilité du patient. Le test doit être réalisé avant le début de la radiothérapie, à partir d’un simple prélèvement sanguin.
Le bénéfice clinique principal de ce test est la personnalisation des doses et des techniques pour l’ensemble des malades.
La radiothérapie constitue un traitement de référence dans la prise en charge des cancers du sein et de la prostate. Son efficacité dépend en grande partie de la dose délivrée à la tumeur. Plus les doses sont élevées, meilleures sont la probabilité de contrôle tumoral et les chances de guérison.
Cependant, plus la dose augmente, plus les effets secondaires sont importants ; cette dose ne peut donc dépasser le seuil de tolérance du patient au risque d’entraîner d’importants effets secondaires.
Un enjeu majeur de la radiobiologie clinique est donc de prédire la radiosensibilité individuelle afin de proposer un traitement sur-mesure, adapté à chaque patient et limiter ces complications. Le test NovaGray RILA® (Radio-Induced Lymphocyte Apoptosis) s’inscrit parmi les outils actuellement disponibles et validés cliniquement.
Principe et mécanisme du test
Le test NovaGray RILA® est un dispositif médical de diagnostic in vitro marqué CE.
Ce test consiste à prélever les lymphocytes circulants du patient, à les exposer ex vivo à un composé chimique copiant une dose standardisée de radiation, puis à mesurer la proportion de lymphocytes apoptotiques par cytométrie en flux.
Le principe sous-jacent est basé sur la démonstration selon laquelle une diminution de la capacité apoptotique des lymphocytes traduit une susceptibilité accrue des tissus normaux à développer des complications post-radiques tardives (Ozsahin et al., 2005; Azria et al., 2015 ; Riou O., G. Crehange et al. Radiation-induced CD8 T-lymphocyte Apoptosis (RILA) and Pelvic toxicity After Prostate Radiotherapy: Results of the Prospective Multicenter French Trial RT. ESTRO Annual Meeting, Glasgow, RadiotherOncol, 2024)
Le résultat du test est exprimé en pourcentage d’apoptose.
Plus le score RILA est bas, plus le risque de développer des toxicités tardives est élevé. À l’inverse, plus le score RILA est élevé, plus le risque de développer des toxicités tardives est faible.
Indications du test
Le test NovaGray RILA® est destiné à l’évaluation du risque de toxicités tardives en amont d’une radiothérapie. Il permet de prédire à 36 mois dans le cancer du sein, le risque de fibrose mammaire et d’effets cutanés sévères principalement, et dans le cancer de la prostate, les toxicités urinaires et digestives retardées.
Pour le cancer du sein, le test est indiqué pour les femmes de plus de 18 ans
- nécessitant une radiothérapie du sein adjuvante post-chirurgicale,
- avec atteinte ganglionnaire ou non,
- avec réceptivité hormonale ou non,
- sans atteinte métastatique.
Pour le cancer de la prostate, le test est indiqué pour les hommes :
- nécessitant un traitement par radiothérapie,
- opéré ou non,
- sans atteinte métastatique.
Modalités de réalisation
Le test est réalisé avant le début du traitement à partir d’un échantillon sanguin du patient.
Il repose sur :
- une analyse biologique (culture cellulaire couplée à une technique de cytométrie en flux),
- suivie d’une analyse algorithmique permettant de calculer le score RILA.
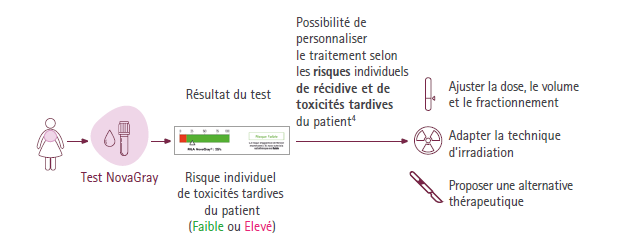
Le résultat du test NovaGray RILA permet de classer le ou la patient.e dans une catégorie de risque (faible /élevé), permettant à l’oncologue radiothérapeute de personnaliser la prise en charge thérapeutique en adaptant les doses et les séances de radiothérapie.
Les résultats sont rendus en 7 jours ce qui ne retarde pas la mise en place du traitement.
Niveau de preuve et validation
Le test NovaGray RILA® a été validé cliniquement par plusieurs études européennes sur plus de 1 500 patients :
- Etude rétrospective mono-centrique (1997, CHUV Lausanne) – test effectué après radiothérapie (Ozsahin et al., 1997).
- Etude prospective mono-centrique (2005, Lausanne, 399 patients) (Ozsahin et al., 2005).
- Etude prospective multi-centrique France (2015, 502 patientes atteintes de cancer du sein) (Azria et al., 2015).
- Etude prospective multi-centrique (2024, 360 patients atteints d’un cancer de la prostate) (Riou O., G. Crehange et al. Radiation-induced CD8 T-lymphocyte Apoptosis (RILA) and Pelvic toxicity After Prostate Radiotherapy: Results of the Prospective Multicenter French Trial RT. ESTRO Annual Meeting, Glasgow, RadiotherOncol, 2024)
Valeur pronostique et données disponibles
Les principales données disponibles issues des études multicentriques réalisées indiquent :
- Une association significative entre un score RILA bas (< 12 % pour le sein) et l’apparition de fibrose mammaire modérée à sévère (Azria et al., 2015)
- Chez les patients atteints de cancer de la prostate, un score RILA bas (<15% pour la prostate) est associé à un risque accru de toxicités tardives, notamment digestives ou urinaires de grade ≥2 (Riou et al., 2024)
Une sensibilité prédictive (pour le sein) estimée à 80 % dans plusieurs cohortes (Azria et al., 2015)
- Une Valeur Prédictive Négative (VPN) RILA Breast de 90% (Azria et al., 2015)
- Une Valeur Prédictive Négative (VPN) RILA Prostate de 78% (Riou et al., 2024.)
Ce test a atteint le plus haut niveau de preuve clinique (niveau I) selon les critères REMARK, édités par l’ASCO (American Society of Clinical Oncology), et est reconnu comme un outil complémentaire d’aide à la décision thérapeutique (Brengues et al., 2017).
Recommandations
Selon les recommandations de la Société Française de Radiothérapie Oncologique (SFRO) (Lapierre et al., 2022), l’identification d’une radiosensibilité individuelle qu’elle soit élevée ou faible doit conduire à une adaptation personnalisée du protocole :
- Ajustement des doses délivrées, du volume et du fractionnement,
- Recours préférentiel aux techniques de modulation d’intensité (IMRT) ou d’optimisation du positionnement (IGRT, DIBH),
- Proposition d’une alternative thérapeutique,
- Surveillance renforcée et suivi spécifique post-thérapeutique.
Intégration en pratique clinique
Depuis mars 2025, plusieurs centres de radiothérapie et de lutte contre le cancer français ont intégré en routine clinique le test NovaGray RILA (Breast® et Prostate®) permettant ainsi d’évaluer le risque individuel de chaque patient de développer des toxicités tardives.
Pour ceux à faible risque, potentiellement sous-traités, il est également possible d’adapter la radiothérapie (dose par fraction accrue, hypo-fractionnement, volumes optimisés), avec un suivi plus allégé.
Études en cours
- PRETORIA (Institut Curie / Institut du Cancer de Montpellier, début 2024 / recrutement toujours en cours) qui évalue la capacité du test NovaGray RILA Breast® à prédire la contracture capsulaire après mastectomie suivie d’une reconstruction implant + radiothérapie, avec suivi à 12 mois (essai clinique national NCT04342546).
- Autres essais : PROBA‑RT (NCT 06382818) qui visera à étendre l’utilisation à d’autres segments thérapeutiques et/ou confirmer l’efficacité du test RILA dans divers scénarios.
Limites du test
Le test évalue la radiosensibilité des tissus sains sans préjuger de la radiosensibilité tumorale. Sa valeur prédictive concerne exclusivement les complications tardives et n’influe pas sur le contrôle tumoral attendu.
Il reste à ce jour le seul test biologique validé pour cet usage spécifique, en attente d’une intégration systématique dans les recommandations internationales.
Perspectives
- Développement de versions multi‑paramétriques qui combinent le score RILA avec des facteurs clinico-biologiques, pour affiner la prédiction des complications tardives (https://nova-gray.com/technologie).
- Extension de l’usage du test à d’autres types de cancer que ceux du sein et de la prostate et de complications.
- Confirmation des résultats des études cliniques en cours/à venir, comme PRETORIA et PROBA‑RT.
- Extension de la réalisation du test NovaGray RILA Breast® et Prostate® en pratique clinique standard.
Le test NovaGray RILA® constitue un outil pertinent et validé pour évaluer le risque de toxicités tardives en radiothérapie du sein et de la prostate. Son utilisation permet une approche personnalisée du traitement, en cohérence avec les recommandations des sociétés savantes actuelles.
En permettant aux médecins d’identifier la stratégie thérapeutique la plus efficace pour chaque patient.e, le test NovaGray RILA® représente une réelle avancée dans la prise en charge des cancers du sein et de la prostate tant sur le plan médical que socio-économique.


Autres articles sur le thème
- Radiothérapie personnalisée
- Toxicités tardives et radiothérapie personnalisée dans le cancer du sein
- Radiothérapie personnalisée et prévention des toxicités tardives dans le cancer de la prostate
- Biomarqueurs prédictifs des toxicités en radiothérapie
- Personnalisation de la radiothérapie : recommandations SFRO et rôle des tests biologiques